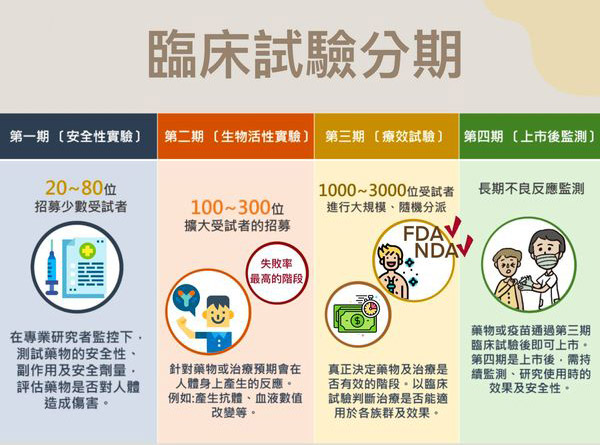
我们在上一篇文章中已经给大家介绍了关于I期临床试验相关知识,那I期之后临床试验的分期和具体的目的是什么呢?
II 期
Phase II Clinical Trial
II期临床试验是新药开发的中间阶段,也被称为治疗作用探索阶段,因为本阶段是在I期试验基础上进一步评估其安全性和有效性。
受试者例数:100-300例。
研究对象:对应适应症的患者。
时间跨度:数月至一年以上。
与I期一样,II期临床试验也分为IIa期和IIb期。
IIa期
Phase IIa Clinical Trials
IIa期旨在评估药物的安全性和初步疗效,并确定适宜的剂量范围。通过在少量受试者(20-200例)身上试验。在此阶段,一个是I期所有的安全性实践,也会在此重现,并且进一步详细展现;第二个还将更有选择性对适应症、适应人群以及目标群体,来更精确评估对目标群体的疗效。在以上基础下,确定适宜的剂量范围。
IIb期
Phase IIb Clinical Trials
IIb期也被称为关键实验(Pivotal Trial),其目的主要是规定药物剂量的疗效研究。相对于IIa期,IIb期更加注重在不同剂量下的疗效评估。此外,此阶段也会做给药方案的研究,通常是双盲、随机对照、多中心的大规模临床试验。
III 期
Phase III Clinical Trials
III期临床试验是指通过更大规模的人体临床试验而全面评价药物的疗效和安全性、剂量的研究阶段,也被称为治疗作用确证阶段和上市前研究。
目的:通过一个或多个试验,进一步验证研究药物对目标群体的疗效和安全性,并且评价利益与风险关系,为最终的药物注册申请审查提供充分依据。
受试者例数:300-3000例。
研究对象:目标适应症的患者。
时间跨度:2-5年。
同样III期临床试验也分为IIIa和IIIb期。
IIIa期
IIIa期是指在新药申请前,通过对研究药物应用于有治疗指征的患者,从而获得更多的疗效和安全性的结果。
IIIb期
IIIb期则是指在提交注册申请之后,获得药品批准并投入生产之前进行。主要目的是为了获取额外的疗效和安全性结果,如经济学和生命质量方面。而对于一些已经上市但需要扩大指征的药物,也可直接进行IIIb期研究。
IV 期
Phase IV Clinical Trials
IV期临床试验(也称为后市场研究)是指在药物上市之后进行的、针对药物使用的真实情况和长期安全性等方面的研究。这种类型的研究可以进一步评估药物的效果和安全性,并探索可能的风险和副作用。与前三个阶段的临床试验相比,第IV期临床试验更关注药物在真实临床实践中的应用情况和效果,更具有现实意义。
受试者例数:大于2000例。
研究对象:普通人群或者特殊人群。
时间跨度:一般不超过四年。
参 考 资 料
1、中华人民共和国药品管理法
https://www.nmpa.gov.cn/xxgk/fgwj/flxzhfg/20190827083801685.html
2、药物Ⅰ期临床试验管理指导原则(试行)
https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/gzwj/gzwjyp/20111202113101617.html
3、中华人民共和国药品管理法实施条例
https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20220509220456183.html
https://www.gov.cn/zhengce/zhengceku/2020-04/28/content_5507145.htm
5、国际多中心药物临床试验指南
https://www.nmpa.gov.cn/yaopin/ypggtg/ypqtgg/20150130120001641.html

 关注微信公众号
关注微信公众号
