先说结论,临床试验结果显示,对于99%的滤泡性淋巴瘤FL患者(包括96%的晚期患者),BMB对预后或缓解评估均无益处
在滤泡性淋巴瘤FL患者的临床实践中,美国威尔康奈尔医学院纽约长老会医院Rutherford等就曾经报告,骨髓活检(BMB)对疗效评估几乎没有价值,因此建议临床试验中不开展BMB。
美国国立综合癌症网络(NCCN)FL指南建议在某些情况下进行BMB和穿刺,如考虑在考虑进行放射治疗的患者或需要检查细胞减少的患者中确认I-II期疾病。
欧洲肿瘤内科学会(ESMO)临床实践指南建议所有新诊断的FL患者都应进行BMB和穿刺,特别是那些怀疑早期疾病的患者。
淋巴瘤临床试验的缓解标准要求在基线进行BMB,然后在基线BMB阳性的患者中重复确认完全缓解(CR)。
该研究假设,只有极少患者基线BMB阳性,影像学CR,随后BMB阳性,只有在此种情况下,BM检测才会对缓解评估结果产生影响。
研究者调查了某一研究机构参加临床试验的99例FL患者,发现仅1%的BMB影响了缓解评估;另一项针对随机GALLIUM临床试验的分析也得到了类似的结果。
本研究目的是在参加国家癌症研究所国家临床试验网络(NCTN)试验的初治FL受试者中证实此结果,以简化未来临床试验要求,改变大多数FL患者需要BMB的实践指南。
研究设计
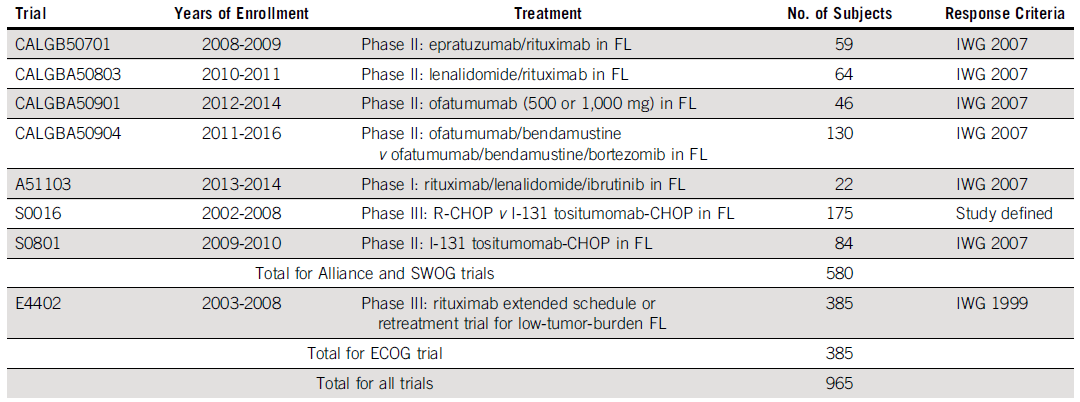
本研究纳入了2008至2016年在临床试验联盟(Alliance)和SWOG癌症试验网完成入组的7项临床试验中的580例初治FL受试者(基线BMB结果、缓解评估期间BMB结果、最佳影像缓解数据均可用),大多数患者为晚期疾病,其中6项试验缓解评估标准为IWG 2006,1项为研究定义的标准。
本研究以入组的受试者总数为分母,计算基线BMB阳性、治疗后影像学CR、重复BMB阳性受试者的比例。
另外一项东部肿瘤协作组(ECOG)临床试验纳入了385例受试者,因其只进行1次BM检测,作为本研究的敏感性分析被单独分析。
表1. 研究总结
研究结果
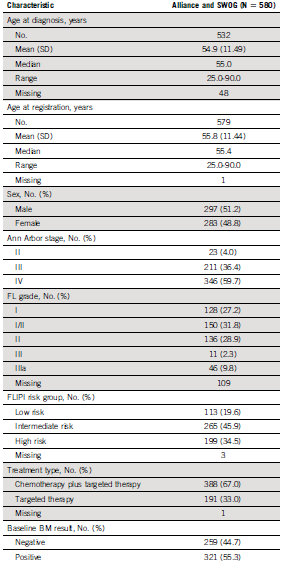
本研究纳入患者中位年龄为55岁(男性51%,III – IV期96%,I – II级88%)。滤泡淋巴瘤国际预后指数(FLIPI)评分低风险20%,中风险46%,高风险35%。67%的受试者接受了化疗方案。55%的受试者基线BMB阳性。
表2. 受试者特征
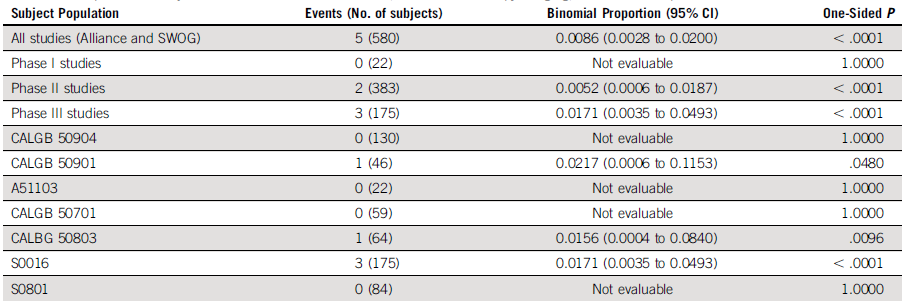
在Alliance和SWOG临床试验中,只有5/580(0.8%)例FL受试者基线BMB阳性、影像学CR、随后BMB阳性(P < 0.0001)。
表3. 基线BMB阳性、治疗后影像学CR、重复BMB阳性的受试者比例
在Alliance和SWOG临床试验中,344例治疗后影像学CR的受试者中,仅1.5%(5 / 344)患者的BMB改变了缓解评估。
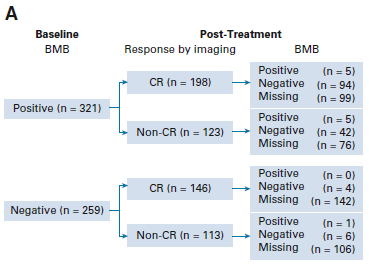
首次放射学CR开始,对Alliance和SWOG临床试验所纳入的初治FL患者进行里程碑生存分析(landmark survival analysis)。对于影像学CR的受试者(n = 187),影像学CR后60天内BMB阴性的受试者(n = 47) vs CR后60天内未重复BMB的受试者(n = 140)的PFS和OS无差异(PFS:HRadj = 1.10,95%CI,0.62 – 1.94,对数秩P = 0.686;OS:HR = 0.59,95%CI,0.23 – 1.53,对数秩P = 0.276)。
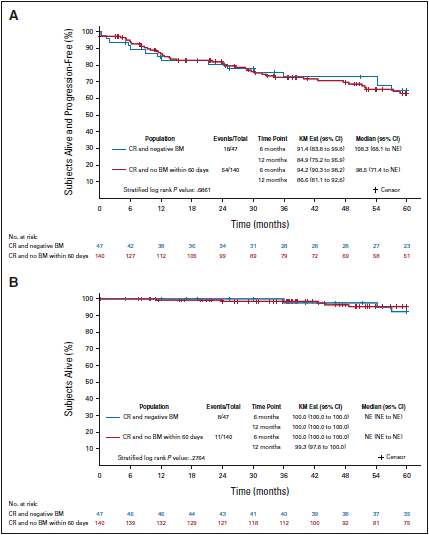
研究结论
本研究结果显示,对于99%的FL患者(包括96%的晚期患者),BMB对预后或缓解评估均无益处。基于这些结果,作者认为BMB应该从FL诊断指南中删除,并且不再作为FL患者临床试验的缓解评估标准。
参考文献
Rutherford SC, et al. Relevance of Bone Marrow Biopsies for Response Assessment in US National Cancer Institute National Clinical Trials Network Follicular Lymphoma Clinical Trials. J Clin Oncol. 2023 Jan 10;41(2):336-342.

 关注微信公众号
关注微信公众号
