病例报告表 CRF/eCRF(Case Report Form)
发布日期:2023-01-03
CRF病例报告表 病例报告表(CRF)是记录临床资料的表格,每个受试者有关的资料均应记录在预先按临床试验方案设计的病例报告表中。 CRF/eCRF根据原始记录来填写,以便申办者对不...
知情同意书ICF(Informed Consent Forms)
发布日期:2022-12-27
临床研究知情同意书IFC 受试者在被告知所有试验信息后,确认他或她自愿参加一个特定试验的意愿过程。知情同意采用书面的、签字并注明日期的知情同意书ICF(Informed consent forms...
伦理委员会IRB/IEC
发布日期:2022-12-25
伦理委员会IEC(Independent Ethics Committee) An independent body (a review board or a committee, institutional, regional, national, or supranational), constituted of ...
受试者 Subject
发布日期:2022-12-25
Subject/Trial Subject :An individual who participates in a clinical trial, either as a recipient of the investigational product(s) or as a control. 对象/试验对象/受试...
不良事件AE(Adverse Event)
发布日期:2022-12-20
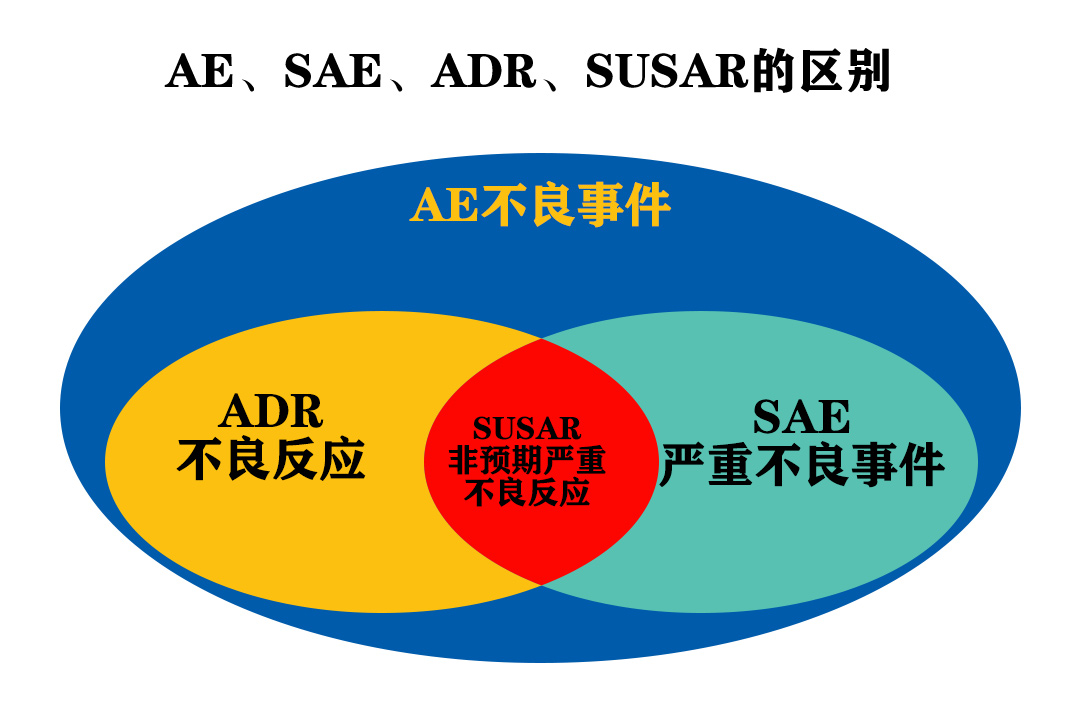
AE、SAE、ADR、SUSAR的区别 不良事件AE(Adverse Event):正在用药的病人或临床试验受试者接受某一药物后出现的任何不良医学事件,并不一定要与治疗有因果关系。 Any untoward...
ICH-GCP中英文对照E6
发布日期:2022-12-18
E6 ICH GCP指导原则 INTRODUCTION 前 言 Good Clinical Practice (GCP) is an international ethical and scientific quality standard for designing, conducting, rec...
不良反应ADR(Adverse drug Reaction)
发布日期:2022-12-17
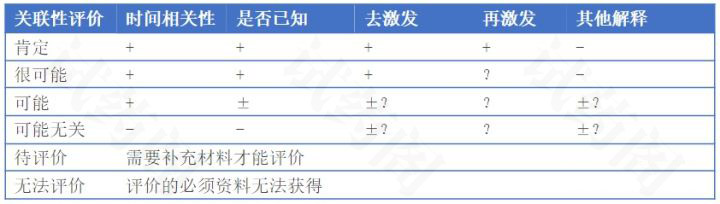
不良反应英文缩写ADR,英文全称Adverse drug Reaction 不良反应在ICH-GCP的定义 In the pre-approval clinical experience with a new medicinal product or its new usages, p...
研究者 Investigator
发布日期:2022-12-17
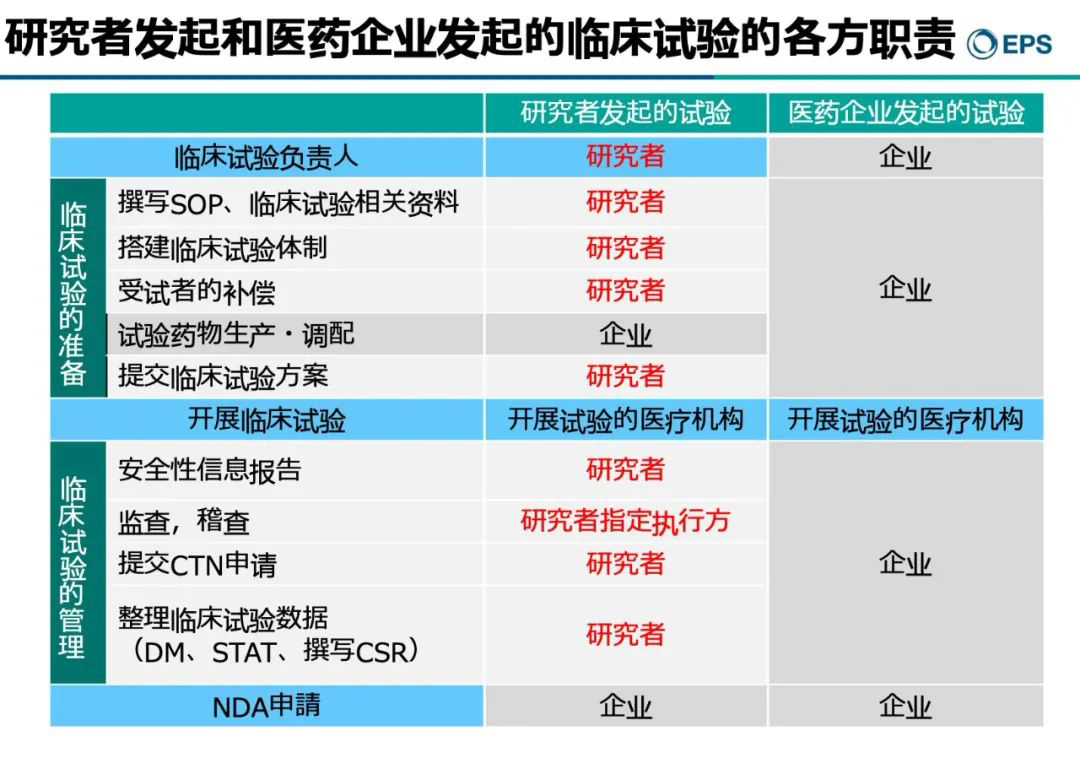
临床试验研究者会议 研究者Investigator,在ICH-GCP 1.34中的定义为:A person responsible for the conduct of the clinical trial at a trial site. 在一家试验中心负责实施临床...
药物临床试验质量管理规范2020版全文
发布日期:2022-12-17
国家药监局 国家卫生健康委关于发布药物临床试验质量管理规范的公告(2020年第57号) 药物临床试验质量管理规范 第一章 总 则 第一条 为保证药物临床试验...







 关注微信公众号
关注微信公众号
