不良反应英文缩写ADR,英文全称Adverse drug Reaction
不良反应在ICH-GCP的定义
In the pre-approval clinical experience with a new medicinal product or its new usages, particularly as the therapeutic dose(s) may not be established: all noxious and unintended responses to a medicinal product related to any dose should be considered adverse drug reactions. The phrase responses to a medicinal product means that a causal relationship between a medicinal product and an adverse event is at least a reasonable possibility, i.e. the relationship cannot be ruled out.
新药或药品的新用途在批准之前的临床实践中,尤其是治疗剂量尚未确定前,ADR是指与药物任何剂量有关的所有有害的和非意求的反应都应被考虑为药物不良反应。该术语用于药品是指在药品与不良反应之间的因果关系至少有一个合理的可能性,即不能排除这种关系。
不良反应在药物临床试验管理规范2020版中的定义
(二十八)药物不良反应,指临床试验中发生的任何与试验用药品可能有关的对人体有害或者非期望的反应。试验用药品与不良事件之间的因果关系至少有一个合理的可能性,即不能排除相关性。
不良反应与不良事件的区别
不良反应ADR是指,受试者在临床试验中出现与试验药物有关的不良事件或者严重不良事件。
不良事件和不良反应的主要区别在于,是否确定与试验药物有关系。
举个例子,某人在参加临床试验,在来院途中与人打架斗殴导致脑震荡,因为脑震荡属于医学事件,所以这也属于不良事件,但这起事件与试验药物无关,故不属于不良反应
不良反应一般都对患者的治疗不利。不良反应是药物所具有的两重性之一,完全没有不良反应的药物是不存在的。
同时,不良反应的发生也是有一定比例的,不是所有使用该药物的患者都会出现不良反应;每个出现不良反应的患者之间,其出现的不良反应表现和程度也不一定相同,存在着很大的个体差异性。不良反应包括6个方面,即副作用、毒性反应、变态反应、继发性反应、后遗效应和致畸作用。
不良反应的判断
《个例药品不良反应收集和报告指导原则》(2018年第131号)将关联性评价分为肯定、很可能、可能、可能无关、待评价和无法评价6级,详见表1。
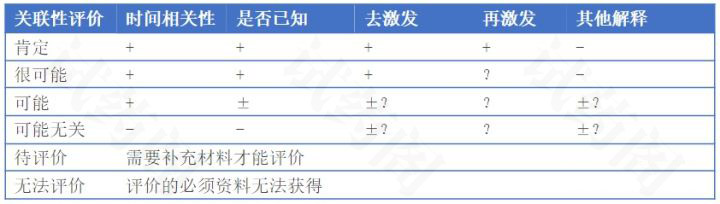
① +表示肯定或阳性;-表示否定或阴性;±表示难以判断;?表示不明。
② 时间相关性:用药与不良反应的出现有无合理的时间关系。
③ 是否已知:不良反应是否符合该药已知的不良反应类型。
④ 去激发:停药或减量后,不良反应是否消失或减轻。
⑤ 再激发:再次使用可疑药品是否再次出现同样的不良反应。
⑥ 其他解释:不良反应是否可用并用药品的作用、患者病情的进展、其他治疗的影响来解释。
如果不良反应对照表中的5条标准,不能完全对应某条可能性时,建议采用保守原则或称之为不利于新药原则,即如果判断结果介于“很可能相关”与“可能相关”之间,应该判“很可能相关”或在信息不足的情况下评估为“可能相关”。当相关性选项中有“无法评价/判断”时,仅在因客观原因无法获得进一步信息,不足以判断因果关系时,才可选择这一选项。

 关注微信公众号
关注微信公众号
