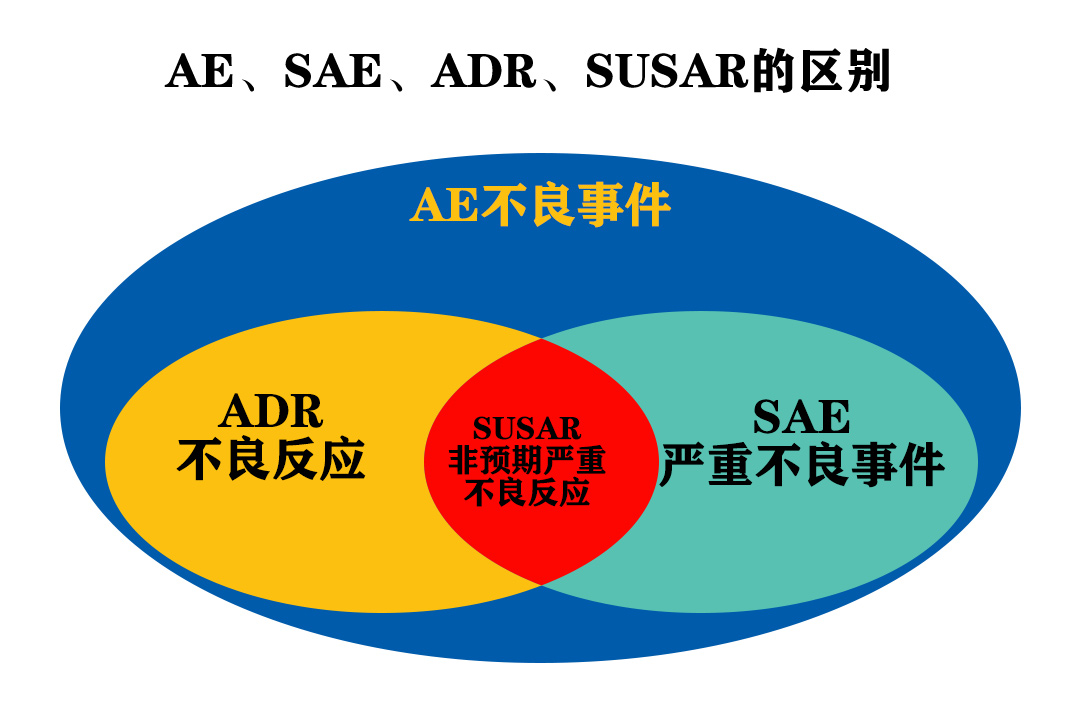
不良事件AE(Adverse Event):正在用药的病人或临床试验受试者接受某一药物后出现的任何不良医学事件,并不一定要与治疗有因果关系。
Any untoward medical occurrence in a patient or clinical investigation subject administered a pharmaceutical product and which does not necessarily have a causal relationship with this treatment.
(个人理解:临床试验期间,志愿者发生的任何不舒服或者健康指标异常,通常从患者签署知情同意书ICF开始到试验结束为止,无论与试验用药是否有关,都需要记录的不良事件)
不良事件AE只需是在时间上相关的不利和非期望的征兆(包括异常的实验室发现)、症状或疾病,而不管其是否与药物有关(参见《ICH临床安全性数据管理指导原则:快速报告的定义和标准》)
An adverse event (AE) can therefore be any unfavourable and unintended sign (including an abnormal laboratory finding), symptom, or disease temporally associated with the use of a medicinal (investigational) product, whether or not related to the medicinal (investigational) product (see the ICH Guideline for Clinical Safety Data Management: Definitions and Standards for Expedited Reporting).
不良事件AE的关键点
- 不良的医学事件:“不良”、“医学事件”
- 时间范围:签署知情同意书ICF后,直到试验结束
- 不一定要与试验用药有关
例1:治疗女性便秘的药物临床试验中,受试者怀孕——AE,
例2:试验过程中,受试者发烧——AE
例3:受试者签署知情同意书后,因感冒导致发烧,广义上来说,肯定是一个AE,但他是在接受试验用药物治疗之前出现,则不属于药物临床试验意义上的AE,不需收集。
AE与ADR是有区别的,临床试验中出现症状加重、病情恶化、新症状、新体征、新疾病和实验室异常都归为AE,
但人体的自然生理状态不属于如婴儿长牙,月经等,周期长达试验出现感冒、咳嗽、腹泻等难免,也归为AE.
不良事件AE的分类(按发生的严重程度)
采用如美国国立癌症研究所常见不良反应事件评价标准(National Cancer Institute Common Terminology Criteria for Adverse Events,NCI CTCAE)、世界卫生组织(World Health Organization,WHO)等分级标准,根据AE的严重程度进行5级划分。
- 1级:轻度,无临床症状或有轻微临床症状;或仅有临床或实验室检查异常;无需进行干预,不需对症处理,不需停药。
- 2级:中度,需要最小的、局部的或无创伤的干预;或日常生活活动受限。主诉不适,需对症处理,不需停药。
- 3级:严重或者具重要医学意义但暂时不会危及生命;导致住院或延长住院时间;致残;日常生活自理受限。主诉明显不适,需对症处理,并需暂停用药。
- 4级:危及生命,需要紧急干预。
- 5级:与AE相关的死亡。
不良事件AE如何处理
住院患者
受试者出现不良事件后,管床医生或值班医生应及时告知研究者PI,如有必要,可先对症处理,由研究者初步评定不良事件的程度分级和与试验药物的相关性,并给予进一步处理意见:
一般不良事件:可密切续观事件的转归或根据试验方案进行相应对症处理;
重要不良事件:研究医师应及时通报主要研究者,并根据方案要求暂停治疗、
调整药物剂量并予以针对性处理等处理,如有必要,PI 可决定是否紧急揭盲;
严重不良事件:按下述第 4 点内容及时处理并按相应 SOP 进行报告。
研究医师根据病情实施处理,如受试者的损害超出研究科室的救治能力时,通知应急小组,启动 “ 防范和处理医疗中受试者损害及突发事件的预案 ”。
门诊患者
获知受试者出现不良事件后,研究者需详细询问受试者当时的症状、体征及所在地点等,对受试者进行必要的解释与开头指导,对不良事件的程度和相关性给予初步评定;
如受试者在当地医疗机构,通过电话与接诊医生取得联系,再次核实不良事件的程度并给予处理意见:
一般不良事件:可赴当地医院初步诊治,并告知密切续观事件的转归;
重要不良事件:如为眼科相关疾病,建议返院接受诊治或赴当地医院接受诊治,并及时通报主要研究者,如当地医院条件有限,应派出医生前往救治。如为非眼科疾病,应在有条件的医院接受诊治。另携带应急信封以备紧急揭盲用。根据方案要求采用暂停治疗、调整药物剂量和对症治疗等处理。
不良事件AE的医学描述、开始日期、结束日期、与研究药物的关系、是否需要治疗、伴随用药、是否被确认为不可逆的AE,以上内容均需记录在原始病历中!

 关注微信公众号
关注微信公众号
