在USA,行业之间的薪资差距不大,因此拥有三四十年工作经验的临床监查员,并非不可想象。
而在中国大陆,更多同行仅将其作为一份入行敲门砖,甚至停留在监查就是收表对数据的阶段,尤其民企超过10年还在做CRA简直难以置信
本文将国外一位资深型同行的教训心得体会,发表在此处,并穿插介绍两个监查小工具,以飨各位临研同道
从业40年,获取的教训数不胜数,但最重要的,当属以下:
知识储备
知识对于我们而言永远是贫乏的,尤其是法规不断变革的制药行业。(我相信他如果到来中国,会为更加频繁的法规变动感到崩溃)一位CRA如果不懂法规,方案,医学现状,医疗特点和研究中心现状,不可能具备开展工作的能力。
- 试验方案的学习,首先是快速浏览一遍找出那些你倍感陌生的专业名词并去弄清楚这些晦涩生硬术语的意思。明确检查和操作程序。
- 医疗特点,了解疾病特点,症状,诊断,标准治疗,病理
- 科室特点,了解科室特点,组织和办公室架构,
- 研究中心现状,包括那些将要负责具体研究职员分工,
目标导向
监查员应具备很多素质,但最重要的是目标导向能力。监查员文档应主要记录和试验质量相关的目标,发现的问题应及时存档,并予以解决。
PI可能对我们监查出的发现有异议,但通过积极讨论解释这些疑问,有助于解决实际问题,并和研究者建立共助关系。
我们关注的是将发现的问题予以存档,而不是将具体的问题归类到具体的人上面。
研究中心职员不喜欢被指责,但他们不会对准确的事实争辩。当然,监查员也可能会犯错,可以在中心的反馈中予以纠正。
如果一个监查意识到研究中心潜在问题的产生,他可以迅速向项目层面发出警告并将明确的发现存档后提交给PM,有助于避免事态蔓延。
创建小结对于效率、准确和时限方面非常有帮助
1. 中心小结
对每家中心创建小结,列出:伦理委员会的审核现状、研究中心职员信息(CVs,资格证书和培训记录),实验室证书(室间质评证书)、研究药物/医疗器械接受记录、备注说明(notestofle),沟通往来信函、和其它关键法规明确的文档明细。
监查期间使用此文档去认定和解释中心发现的问题。在监查周期间更新的沟通往来,及其它内容,整合进入此文档。
国际上顶尖外企药厂,习惯于用MVR将这些信息记录并整合。但MVR一般较多,长达二三十页,主要是给申办方看的,不便CRA自我管理,因此设计这个表格自身用。
MVR和Site Summary之间的区别,类似于Project Plan和Project Oversight Tracking Form之间的区别,如果您没使用过Project Oversight Tracking Form管理您的项目,可后台留言索取相关截图。
2. 受试者小结
创建一份受试者小结(也称为监查备忘录) ,以管理你负责中心的每位试验参加者。样表见于下图:
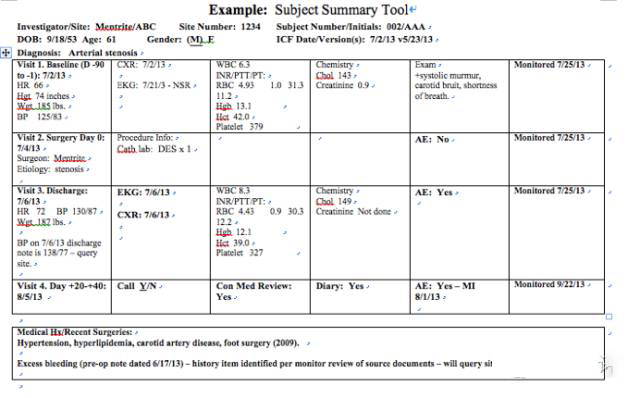
美国这位超级资深CRA同学所用的这份文档主要用于监查员追踪监查程度和关键数据点。可与中心或PM分享用于解释。
受试者小结内容因研究各异,但本质上是需要列出方案时间表(流程图中随访安排)的活动列表。
尽可能的使用你的受试者小结说明对应原始文档信息,使你出具的Query清晰透明,例如病史载明患者在2013年6月17日存在过度出血,见于外科大夫写的手术记录提示单,请研究者确认后将信息整合入受试者病史中。
同样的,在书写监查报告时,我们仍可以参考受试者小结和文档附件,例如,监查时浏览文档的深度和程度,相关发现,诸如AE、偏离、原始文档问题、和药物/器械管理责任。工具帮你对项目管理团队针对某受试者发起疑问时快速予以回答
对于使用EDC的query,中心随访前审阅数据库登录情况,和受试者小结已载录的信息。抵达研究中心前,首先浏览原始文档并更新受试者小结信息,然后对EDC系统载录信息进行对应的监查。
总结
掌握法规、方案,小结工具,掌握研究中心信息和试验进展,抵达研究中心时准确完成监查拜访,与研究职员有效沟通,减少因信息了解不充分不全面导致的摩擦。

 关注微信公众号
关注微信公众号
