
申办者/申办方(Sponsor),全称是申报主办者,指发起一项临床试验,并对该试验的启动、管理、财务和监查负责的个人、公司、机构或组织。
谁可以成为申办者
依据我国《药品注册管理办法》,药物临床研究的申办者必须是有法人资格的单位,若申办者为外国机构,则必须有一名在中国具有法人资格的代表。
申办者理论上也可以是个人,如果是由研究者个人或者与别人合作发起一项临床试验,那么国际上称其为申办研究者。
ICH-GCP section 1.53:An individual, company, institution, or organization which takes responsibility for the initiation, management, and/or financing of a clinical trial.
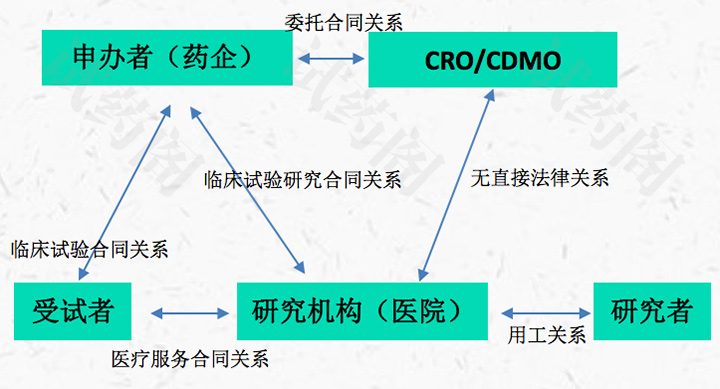
在我国,申办者通常就是一家制药企业,为了让其生产的药品获得上市销售资格,投入资金发起临床试验。
申办者与CRO的关系
临床试验是一种以人体为研究对象的研究,因此,申办方需建立一个强有力的质量体系,从而保护人体、受试者和实验的安全性。
临床试验是一个包含许多跨学科行为的过程,如实验方案设计、临床实验机构的选择、受试者的管理、数据管理、统计、分析以及等等
申办方通常不会亲自开展临床实验,而是选择一个专业的合同研究组织CRO来完成这些职能。
经验丰富的CRO机构可以高效正确处理临床试验业务,以获得有效和有意义的结果
申办方的职责有哪些
1、申办方应确保临床实验的开展具备可行性,提供临床试验批件、药检报告、及临床前研究资料以启动临床试验。
2、申办方必须选择具有适当经验和适当培训的合格研究者进行实验。
3、需要向研究者提供临终实验方案,需要向研究者提供研究者手册以及其他重要信息。
4、申办方需要和研究者和研究机构达成临床实验协议,并获取研究的财务报表。
5、在试验开始前或临床试验期间,对试验中记录的临床数据进行各种分析、审查,并由适当的权威机构授予开展权限。
6、所有的试验药品,申办方需要检查其发货情况、处理情况、存储情况、给药情况以及退回和销毁情况,以及试验期间使用的其他药品和设备。
7、申办方应向所有相关人员和机构报告实验过程中出现的所有的新信息,如伦理委员会、临床实验机构、监管当局和其他利益的相关者。
8、申办方需要选择合格的临床监察员 CRA 来监督实验的进展。 CRA 需要监督实验的进行。是否遵守临床实验方案。 GCP 和当地法规
9、申办方有责任确保所有的参与人员都按照规定接受了良好的培训。所有的参与人员都应该清除自己的角色和责任。

总之,申办方还有其他众多的责任,以获得可靠有效的临床试验结果。

 关注微信公众号
关注微信公众号
