方案偏离英文缩写PD,英文全称Protocol Deviation,是指任何偏离和不遵循经伦理委员会批准的试验方案、操作流程的行为。
一般来说,这种偏离不会对受试者的安全和获益产生实质性的作用,也不会影响所收集数据的价值。
方案违背(Protocol violation)
方案违背是偏离IRB批准的方案的一种,它可影响到受试者的权益,安全性和获益,或研究数据的完整性,精确性和可靠性。
这里可以看得出来,方案PV是PD的一种,PV比PD严重,就像SAE和AE一样的关系。
PD和PV的区别是严重程度或是否影响受试者的权益,安全性和获益,或研究数据的完整性,精确性和可靠性。
常见的方案偏离PD形式
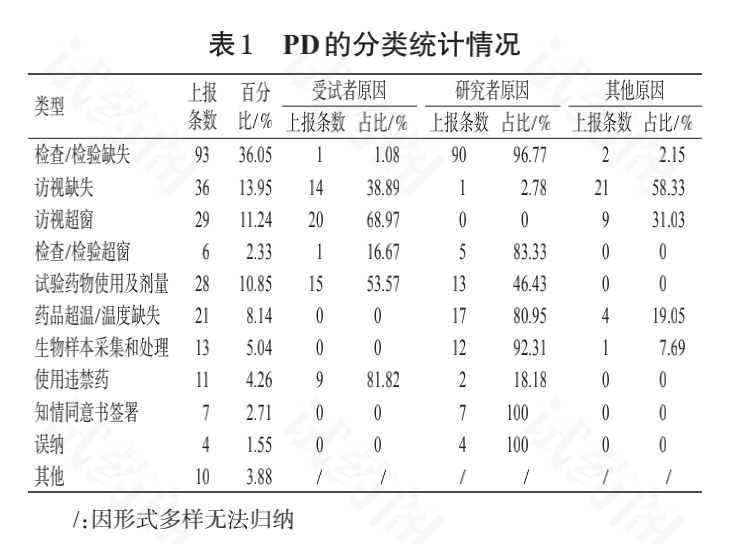
2.1 检查/检验缺失
检查/检验缺失是指受试者未按方案要求进行相应的检查、检验,是最常见的 PD。
此类 PD 的严重程度视方案而定。如某慢性阻塞性肺病项目需要排除结核阳性患者,受试者未进行结核检验就已入组并用药,补测后若发现患者结核检验结果为阳性,则属于重大 PD。
如果为常规实验室检测,那么缺失的检查/检验不影响受试者入组、排除及随机分层等情况,则属于常规PD。
在笔者管理项目上报的258条PD中,涉及检查/检验缺失的PD共计93条,占比为36.05%。导致此类PD的主要原因如下:
(1)受试者原因——患者在进行大便常规检查时未按要求操作,致使某些结果未检出(共计1条,占此类 PD 的 1.08%)。
(2)研究者原因——①研究者对方案不熟悉,漏开了相应的检查/检验(共计87条,占此类PD的93.55%);②研究者开具了相关的检查/检验,研究护士也按方案采样,但送样时漏送,导致某结果缺失(共 计3条,占此类PD的3.22%)。
(3)其他原因——血生化和血糖原本只需要1份血样即可出具血生化和血糖检测结果,后因检验科更新系统,血生化检测和空腹血糖检测需要采集2管血样送检,但专业科室只采血1份,导致血糖结果缺失(共计2条,占此类PD的2.15%)。
2.2 访视缺失
访视缺失是指受试者未按照试验方案要求来院随访,此类PD的严重程度视方案而定。
若此次访视需要检查/检验的某些关键指标涉及受试者中止或退出临床试验、二次随机用药等,则属于重大PD。
如某卵巢癌项目需要在用药6个周期后进行二次随机分组,若此次受试者访视缺失就属于重大PD。
在笔者管理项目上报的258 条 PD 中,涉及访视缺失的 PD 共计 36 条,占比为13.95%。导致此类 PD 的主要原因如下:
(1)受试者原因——患者因自身原因不能按时来院随访(共计14条,占此类PD的38.89%)。
(2)研究者原因——研究者工作疏漏致受试者访视缺失(共计1 条 ,占此类PD 的 2.78%)。
(3)其他原因——受外界不可抗力的影响,如受疫情影响,部分受试者因所处地区疫情管控封锁,不能按照窗口期时间来院随访(共计 21 条,占此类 PD 的58.33%)。
2.3 访视超窗
访视超窗是指受试者未按照试验方案要求的时间返院,是较为常见的PD。
在笔者管理项目上报的258条PD中,涉及访视超窗的PD共计29条,占比为11.24%。导致此类PD的主要原因如下:
(1)受试者原因——患者因自身原因不能按时来院随访(共计20条,占此类PD的68.97%)。
(2)其他原因——受疫情等外界不可抗力的影响,不能按照窗口期时间来院随访(共计9条,占此类PD的31.03%)。
2.4 检查/检验超窗
检查/检验超窗是指受试者检查、检验结果超过试验方案规定的窗口期。
在笔者管理项目上报的258条PD中,涉及检查/检验超窗的 PD 共计 6 条,占比为 2.33%。导致此类PD的主要原因如下:
(1)受试者原因——因受试者访视超窗,导致规定的检查/检验不能按时完成(共 计1条,占此类PD的16.67%)。
(2)研究者原因——①研究者对试验方案不熟悉,漏开了相应的检查/检验(共计4条,占此类PD的66.67%);②受试者虽然在入组前做过相关检查/检验,但超过了入组规定的期限,研究者出于对受试者安全性及伦理的考虑,决定直接采用已有的结果(共计1条,占此类PD的16.67%)。
2.5 试验药物使用及剂量
在笔者管理项目上报的258条PD中,涉及试验药物使用及剂量的PD共计28条,占比为10.85%。导致此类PD的主要原因如下:
(1)受试者原因——未按试验方案规定的剂量使用药物,出现药物漏服、多服的情况(共计15 条,占此类 PD 的 53.57%)。
(2)研究者原因——研究者对方案不熟悉(共计13条,占此类PD的46.43%)
例如方案规定,患者出现某种不良事件(adverse event,AE)且严重程度分级为4级时,需要停用药物,但研究者仍开具试验药物并给患者使用;
又如方案规定,连续停用药物2次以上的受试者应退出研究,但研究者在实际过程中未通知受试者出组;再如方案规定,试验过程中试验药物的剂量只能下调,但研究者在受试者AE改善后却将药物剂量调整为原始剂量。
2.6 药品超温/温度缺失
药品管理是临床试验的重要环节。在笔者管理项目上报的258条PD中,涉及药品超温/温度缺失的PD共 计21条,占比为8.14%。导致此类PD的原因主要如下: (1)研究者原因——药品管理员取药时打开冰箱的时间过长(共计 17 条,占此类 PD 的 80.95%)。(2)其他原因——温度计损坏导致某时段温度缺失(共计4条,占此类PD的19.05%)。
2.7 生物样本采集和处理
生物样本采集和处理为临床试验的关键环节,其采集和处理的规范性直接影响临床试验的主要、次要疗效指标结果的准确性,进而影响受试者的安全性。
在笔者管理项目上报的258条PD中,涉及生物样本采集和处理的PD共计13条,占比为5.04%。此类PD主要包括样本离心时间过长、静置时间不符合要求、采集时间超窗、采集点漏采、超温等。导致此类PD的原因主要如下:
(1)研究者原因——①研究者安排受试者随访时没有考虑样本采集护士的排班情况,将多个受试者的随访时间安排为同一天的同一时段,导致生物样本采集超窗(共计8 条,占此类 PD 的 61.54%);②授权的研究护士、临床研究协调员(clinical research coordinator,CRC)等对生物样本采集相关标准操作规程(standard operating procedure,SOP)及操作手册不熟悉,导致生物样本采集超窗、采集点漏采(共计4条,占此类PD的30.77%)。
(2)其他原因——样本采集后,贮藏过程中超温(共计1条,占此类PD的7.69%)。
2.8 使用违禁药
使用违禁药是指受试者在组期间,使用试验方案中明确禁止的药物,属于重大 PD。在笔者管理项目上报的258条PD中,涉及使用违禁药的PD共计11条,占比为4.26%。导致此类PD的原因主要如下:
(1)受试者原因——受试者在其他科室或外院复诊,复诊医师按照诊疗常规开具相关药物(共计9条,占此类PD的81.82%)。
(2)研究者原因——研究者对试验方案不熟悉,对违禁药的范围不清楚,故开具了相关药物(共计2条,占此类PD的18.18%)。
2.9 知情同意书签署
知情同意书签署应严格按照GCP及试验方案执行,新版本知情同意书经过伦理审查后,研究者应及时让在组受试者签署,筛选失败的受试者所签署的知情同意书也应保留在受试者文件夹中。
在笔者管理项目上报的 258条PD中,涉及知情同意书签署相关的PD共计7条,占比为2.71%。导致此类PD出现的原因均与研究者有关:
(1)研究者丢失了筛选失败的受试者所签署的知情同意书原件,仅留存了扫描件(共计 6 条,占此类PD的85.71%)。
(2)新版本知情同意书经过伦理审查后,研究者未及时与受试者签署(共计 1 条,占此类 PD 的14.29%)。
2.10 误纳
误纳是指受试者在不符合入组标准或者符合排除标准的条件下,被研究者错误地纳入某项研究的情况。此类 PD 相对较少,但严重程度高,属于重大 PD。
在笔者管理项目上报的 258 条 PD 中,涉及误纳的 PD 共计 4 条,占比为 1.55%。导致此类 PD 的原因主要与研究者相关:
(1)研究者对试验方案不够熟悉,审核入组时不够仔细(共计3条,占此类PD的75.00%)。
(2)患者的外院病历在本院系统中无法查询,研究者在询问患者病史时不够仔细,导致入组后才发现受试者违背了纳入标准(共计1条,占此类PD的25.00%)。
2.11 其他
在笔者管理项目上报的258条PD中,还存在因形式多样无法归纳的情况:2 例受试者日记卡漏填,占比为0.78%;2例受试者的生命体征收集超窗,占比为0.78%; 2例受试者在检验结果未出时就先获取了随机号,占比为0.78%;2例受试者的生命体征漏采,占比为0.78%;1例受试者的日记卡丢失,占比为0.39%;1例受试者的药物包装损毁,占比为0.39%。
方案偏离PD怎么处理
监查员在监查时,如果发现偏离方案时应做好记录。有的试验针对违反方案要求填写“违反方案记录表”,详细记录发现的时间、事件发生的时间及过程、原因及相应的处理措施,并通报伦理委员会及申办者
向伦理委员会报告PD,一般为每月1次定期报告,但当发生严重的方案违背时要求立即报告
引起PD的原因多样,如申办方原因、研究者原因、受试者原因、外界不可抗力因素等,导致临床试验质量降低。减少临床试验中PD的发生,需要申办方、研究者、CRC、受试者及监管部门多方努力学习并加以改善


 关注微信公众号
关注微信公众号
