病例报告表(CRF)是记录受试者的症状、体征或实验室检查等各种数据的文件,申报方需要分析和总结CRF中的数据,形成申请新药批准的临床试验研究报告。
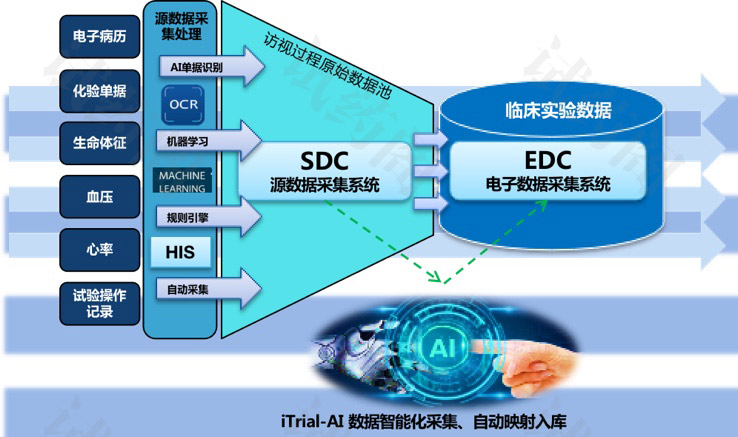
CRF一般有两种形式的,一种是传统纸质版,一种是电子版存在的也称为EDC系统。现在大部分试验都直接采用EDC系统去收集数据
设计CRF的目的
在药物临床试验项目中,不管你试验方案写的多好,受试者的试验信息总得需要一项一项的去收集,比如受试者今天给药的剂量?有没有不良反应? 各项化验指标是多少?
因此我们需要一个标准的病例报告表去记录这些信息,避免漏掉一些关键的数据收集。
所以在临床试验实施之前就要设计好病例报告表,也就是CRF。
CRF设计和审批
在临床研究中,研究方案确定后,最重要的就是设计CRF,它是临床试验数据质量和真实性的关键。其实,临床研究的过程也就是临床研究人员完成CRF的过程。
CRF的设计、修改及最后确认会涉及多方人员的参与,包括申办者、申办者委托的CRO、研究者、数据管理和统计人员等。
一般而言,CRF初稿由申办者或CRO完成,但其修改与完善由上述各方共同参与,最终定稿必须由申办者或申办者委托的CRO完成。
对EDC的要求
我国药审中心对于EDC系统的基本功能还作出了要求,主要包含:eCRF构建、数据保存和稽查轨迹、自动核查、数据质疑管理、源数据核查确认、电子签名、数据库的锁定、数据存储和导出等功能。
并且EDC系统应具有生成符合临床试验方案的电子临床病例报告表(eCRF)的功能。对于使用纸质病例报告表的临床试验,机构应保存所有纸质病例报告表的复印件。
对于使用电子数据试验,临床试验数据管理系统的供应商应为临床研究机构提供一份所有电子病例报告表的PDF文件格式以备案。
在日常的工作中关于CRF/EDC相关研究人员要知道的事项如下:
- CRF需要填写的部分不应留空,除非由专门注明
- 当受试者完成访视后,尽量在3个工作日内将所产生的数据录入至CRF中
- 因为是电子数据收集系统,所以每一次修改都会留下痕迹,需谨慎操作,所有检查报告的异常值需要等研究者评估后方可进行录入,不要出现前后逻辑矛盾的情形。
- 再次强调,CFR只是转录源数据的信息,所以没有源数据做支撑,不可以随意录入数据至CRF中,时刻谨记“没有记录就没有发生”。
关于CRF设计的内容中,一些大家比较关心的问题分享给大家:
Q:关于AE级别变化的记录请问是如何考量的?
A:一般级别加重新才需新记录一条,如果只要级别变化都记的话,对统计来说也是需要头尾合并,有时候出错概率比较大。且分析结果很多时候是看人数,并不看AE的数量。
个人理解:实际项目中,遇到有一个项目统计要求级别变化全记,因为他们想分析比如从3级到2级的恢复时长,这种就另说。于是在AE表多设计了一列“AE编号”比如级别1 3 2 1这4条AE属于同一个AE,就在这4条AE编号填写上001来表示这是同一条AE。
Q:关于肿瘤试验中的服药记录是按 实际访视日期 记录还是按 计划周期 记录更好?
A:只要记录过程中没有间隔就行,保证整个试验期间的服药情况都有记录即可。
个人理解:这么多项目还是单独设计“服药记录表“最实用,层级与AE和CM同一级,不要放在每个访视里。且规定好是记录受试者实际服药而不是研究者判断的。比如有时候会碰到这样的情况:大概是研究者说这个情况需要暂停用药(这个可能记录在原始病历上),但受试者实际没停,就应该按实际记录。
Q:受试者失访后已退出研究,但通过某些渠道获知了死亡日期,这个死亡日期可以收录吗?
A:这个日期肯定是可以收的,但是不属于知情范围里的数据,大概率是不能录到EDC里的。(但是计算临床终点OS还是可以使用)
个人理解:这个问题本人觉得很有意思,临床试验是一个特别注重合法合规的事情,需要考虑伦理受试者权益安全等实际“大方向”的问题。
死亡日期对最终分析结果是很重要的数据,从这个角度,能拿到那没商量就必须使用这种感觉。
但从实际生活中来看,逝者为大,且家属很多时候大概不愿提起亲人死亡这件事情,为了项目目的去打听受试者死亡日期,听起来就很冰冷挺不近人情的
所以回答里括号中的内容其实我有点忘了是不是这个意思,实际操作过程中大概需要运营同事更有技巧地去获得吧。
Q:某计划访视点没来,下一访视数据是隔着录还是按计划录?比如Cycle 2没来,Cycle 3来了,那Cycle 3的数据录在Cycle 2还是Cycle 3?
A:建议录在Cycle3,因为Cycle 2也需要记录unscheduled的信息,而且一般肿瘤临床试验是根据服药来定义周期。
Q:在某一次计划内访视后结束治疗,该次访视的数据录在EOT(结束治疗访视)还是计划访视时间点里?
A:建议录入到EOT访视里,因为EOT访视做的检查项一般会多于计划访视。
个人理解:支持,CCG填写指南里写清楚,CRA和CRC朋友之间传达到位即可。

病例报告表是临床试验中不可缺少的一种工具,它被用来收集、分析和记录临床试验观察到的有关患者的一些生物学、临床数据

 关注微信公众号
关注微信公众号
