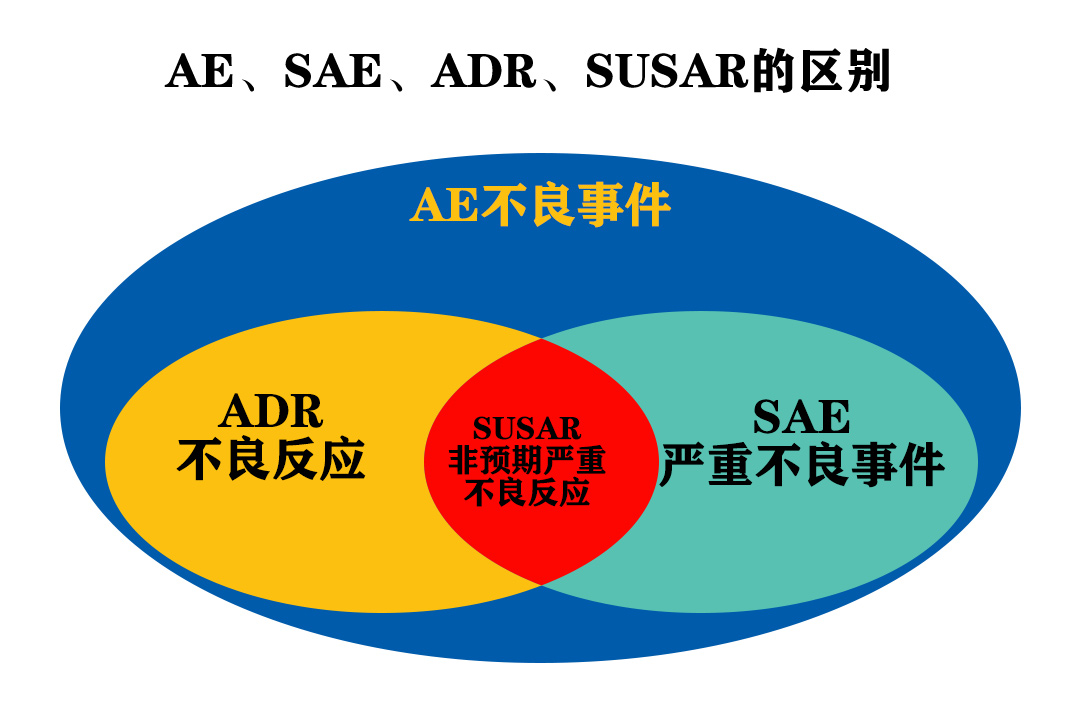
Serious Adverse Event (SAE) or Serious Adverse Drug Reaction (Serious ADR):Any untoward medical occurrence that at any dose:results in death、is life-threatening、requires inpatient hospitalization or prolongation of existing hospitalization、results in persistent or significant disability/incapacity,or is a congenital anomaly/birth defect
严重不良事件: 指受试者接受试验用药品后出现死亡、危及生命、需要住院治疗或者延长住院时间、永久或者严重的残疾或者功能丧失,以及先天性异常或者出生缺陷。
严重不良事件SAE怎么报告
(一) 报告对象及时限:
临床试验过程中发生严重不良事件的,研究者应当在24小时内报告有关省、自治区、直辖市药品监督管理部门和国家食品药品监督管理局,通知申请人,并及时向伦理委员会报告。
药品临床试验中发生严重不良事件,应按GCP的要求在规定时间内分别报告国家药品监督管理局药品注册司、安全监管司;
Ⅳ期临床试验中发生的新的不良反应和严重不良事件同时报国家药品不良反应监测中心。
申办者应与研究者迅速研究所发生的严重不良事件,采取必要的措施以保证受试者的安全和权益,并及时向药品监督管理部门 和 卫生行政部门报告,同时向涉及同一药物的临床试验的其他研究者通报。
另外,卫生部2011年的时候颁布了一份《药品不良反应报告和监测管理办法》,主要是针对药品上市后监管的。其中有如下规定:
第二十一条 药品生产、经营企业和医疗机构发现或者获知新的、严重的药品不良反应应当在15日内报告,其中死亡病例须立即报告;其他药品不良反应应当在30日内报告。有随访信息的,应当及时报告。
药品生产企业应当对获知的死亡病例进行调查,详细了解死亡病例的基本信息、药品使用情况、不良反应发生及诊治情况等,并在15日内完成调查报告,报药品生产企业所在地的省级药品不良反应监测机构。
第三十三条 进口药品和国产药品在境外发生的严重药品不良反应(包括自发报告系统收集的、上市后临床研究发现的、文献报道的),药品生产企业应当填写《境外发生的药品不良反应/事件报告表》(见附表3),自获知之日起30日内报送国家药品不良反应监测中心。国家药品不良反应监测中心要求提供原始报表及相关信息的,药品生产企业应当在5日内提交。
第三十五条 进口药品和国产药品在境外因药品不良反应被暂停销售、使用或者撤市的,药品生产企业应当在获知后24小时内书面报国家食品药品监督管理局和国家药品不良反应监测中心。
第三十七条 设立新药监测期的国产药品,应当自取得批准证明文件之日起每满1年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次;其他国产药品,每5年报告一次。首次进口的药品,自取得进口药品批准证明文件之日起每满一年提交一次定期安全性更新报告,直至首次再注册,之后每5年报告一次。定期安全性更新报告的汇总时间以取得药品批准证明文件的日期为起点计,上报日期应当在汇总数据截止日期后60日内。
(二)SAE的报告内容:
“首次报告”应包含但不限于以下信息:
- 患者入组编号,入组时间和入组临床试验名称(编号),患者诊断和既往重要病史或合并疾病
- 入组后已完成的疗程和发生SAE前的末次用药时间
- 发生SAE前的相关症状、体征、程度分级,行相关检查和治疗的情况
- 确认为$AE后的详细救治过程,有助于证实SAE严重性的检查结果等
- 研究者判断该SAE与试验用药或方法的相关性
- .其他
(三) 报告表格:
各个药厂有各自的严重不良事件报告表。国内官方的严重不良事件报告表有两个版本:
- 2000年药监局发布的《药品临床研究的若干规定》里的附表2。
- 总局药品评价中心,即国家药品不良反应监测中心网站上的《上市前临床试验严重不良事件报告表》。
其中,第二个表格是被广泛使用的。
(四) 报告方式:
1. 严重不良事件报告给国家药品监督管理局药品注册司:
- 首选通过传真报告:
- 传真号码: 010-8836 3228
- 器械SAE传真号码: 010-6858 6295
- 如遇无法传真,须以EMS方式邮寄纸质报告:
- 地址: 北京市西城区宣武门西大街26号院2号楼,国家食品药品监督管理局注册司研究监督处
- 邮编: 100053
- 保留好传真失败记录,及EMS快递单底单。
2. 严重不良事件报告给国家药品监督管理局安全监管司:
3. 省、自治区、直辖市药品监督管理部门:
4. 疫苗临床试验严重不良事件报告:
2014年药监局发布了《疫苗临床试验严重不良事件报告管理规定(试行)》。其中规定了,可疑且非预期严重不良反应(SUSAR)等个案报告以及定期安全性报告由申办者按《规定》向总局药品审评中心报送。并以纸质 和 电子方式报告给总局药品审评中心资料组:
- 纸质报告以快递的形式寄送,用于存档:
- 收件人:国家食品药品监督管理总局药品审评中心资料组
- 地址:北京市海淀区复兴路甲1号
- 邮编:100038
- 纸质报告须附临床试验批件复印件,并加盖公章。
- 电子报告可选择传真或电子邮箱:
- 传真号码:010-68584220
- 电子邮箱:susar@cde.org.cn。
药物/器械临床试验严重不良事件报告流程完整流程:
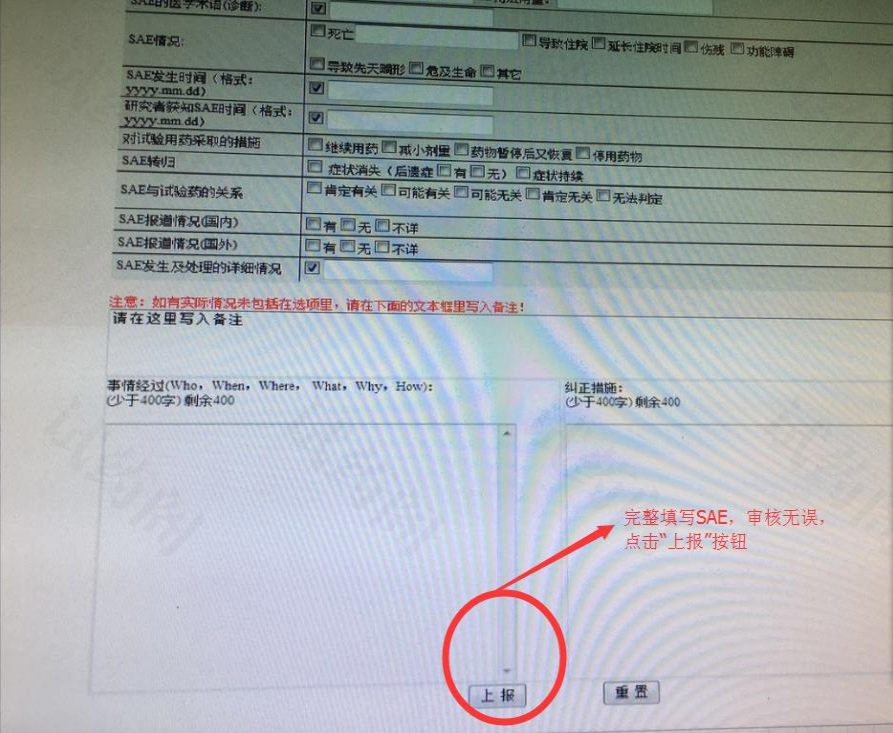
①医院办公网→②质量管理(质量管理网站)→③意外事件上报入口(质量管理信息中心)→④登陆账号密码(即HIS 系统的账号密码)→⑤点击上报临床试验 SAE 的链接→⑥完整填报 SAE,预览SAE,审核无误,点击“上报”按钮;同时,打印纸质版 SAE 并签名签日期,再上报伦理委员会。提醒:电子版 SAE 上报和纸质版 SAE 递交同步进行。

 关注微信公众号
关注微信公众号
