
参加肿瘤项目的临床试验患者如何度过疫情
随着我国疫情防控政策调整,多地已全面取消常规核酸检测。据国家疾控中心专家预测,放开后整体人群累计感染率将高达 80%~90%;几乎每个人可能至少都会经历一次感染。根据《柳叶刀·肿瘤》研究发现,现患肿瘤的患者,以及经过手术等治疗后康复的患者,相比非肿瘤患者,其重症/死亡的风险分别增加了4倍和2倍。肿瘤患者普遍免疫力较低,尤其接受放化疗等具有免疫抑制作用的治疗期间,患者自身免疫清除能力低,病灶入侵时更容易导致病毒繁殖和扩散,引起重症的发生。尽管奥密克戎毒力下降(约为原毒株的1/10到1/20),而且放开后感染不可能完全避免,需要尽可能做好防护,避免过早感染和反复多次感染。
参加临床试验的肿瘤患者作为特殊群体,在这一特殊时期应该如何平稳度过呢?有哪些注意事项呢?临床试验访视以及患者管理有哪些注意事项?我们综合了国内外相关的指南和共识相关意见,指导如下:
1. 新冠病毒感染肿瘤患者严重程度分级
根据《NCCN 癌症相关感染的预防和治疗指南 2022.3 版》意见,新冠病毒感染患者结合临床症状、影像学检查、血氧饱和度、动脉血氧分压与吸入氧浓度之比、是否辅助通气等分为无症状感染、轻、中、重度及危重症(详见表1)。
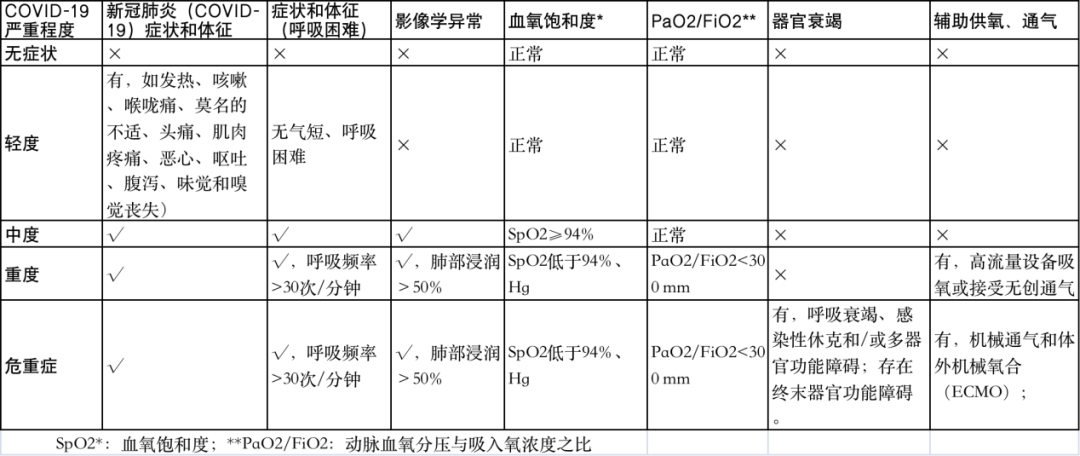
表1 新冠病毒感染肿瘤患者严重程度
2. 新冠病毒感染肿瘤患者抗肿瘤治疗时机建议
肿瘤患者在出现新冠感染症状或确诊为新冠病毒感染后,建议根据严重程度尽早去当地医疗机构就诊治疗;无法线下就诊患者可选择在正规医疗机构的互联网医院进行咨询推荐后治疗;身体状况较好,未合并严重基础疾病的无症状或症状轻微,基础疾病处于稳定期,无严重心肝肺肾脑等重要脏器功能不全等需要住院治疗情况的感染者的感染者,可选择官方网站推荐的药物居家对症治疗。
新冠病毒感染的肿瘤患者,建议推迟抗肿瘤治疗。根据《共识》建议在相关症状完全缓解,新冠病毒核酸检测连续 2 次阴性,间隔 24 小时,可考虑重启抗肿瘤治疗。根据《NCCN指南》安全起见,建议无症状和轻中度症患者抗肿瘤治疗与新冠转阴后间隔 10-14 天,重症患者间隔 20 天(详见表2)。
也有研究者认为靶向治疗、内分泌治疗等对免疫功能影响很小,即使感染也可以继续使用。当然,如果肿瘤病情处于快速发展的阶段,可能造成严重后果的话,则应寻求主管医生权衡利弊,必要时可以在严密监控下使用抗肿瘤治疗,或者换用低毒的药物进行过渡。
因此是否可以重启抗肿瘤治疗,建议对患者进行个体化讨论,充分评估抗肿瘤治疗指征、治疗目标以及治疗耐受性等因素,合理选择重启时间。
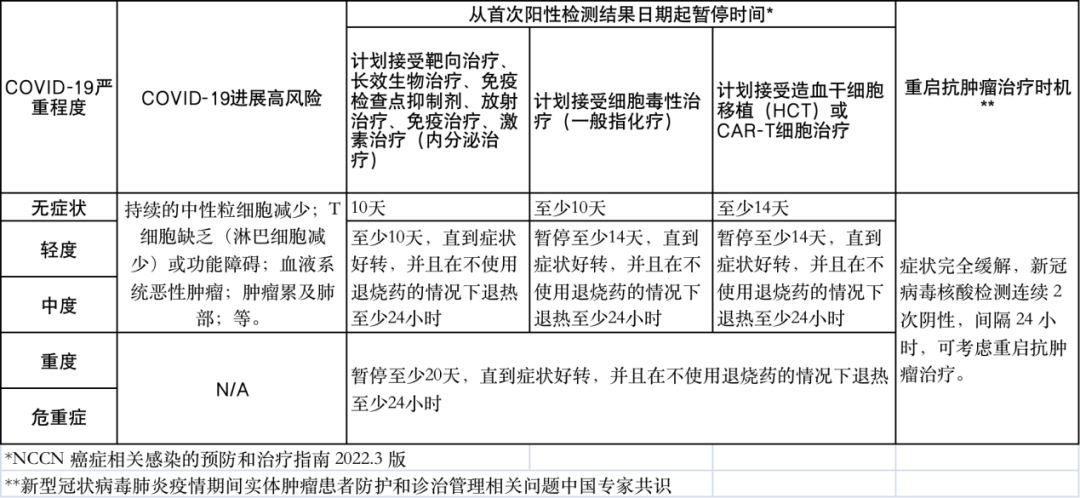
表2 新冠病毒感染肿瘤患者暂停用药建议
3. 新冠病毒感染肿瘤临床试验患者访视建议
对于院外参加临床试验的肿瘤患者在遇到新冠阳性后,可参考上述暂停用药建议。症状完全缓解、新冠病毒核酸检测连续2次阴性,间隔24小时,可根据不同用药途径,选择不同的访视方式(详见表3)。
研究药物为口服药,根据新冠病毒核酸检测结果决定是否需要返院:连续2次阴性,间隔24小时可直接返院进行后续访视;若持续核酸检测阳性,则根据症状严重程度,选择是否在当地二级以上医院进行安全性检查之后,再将相关结果发给研究者进行评估及审核,由研究者决定是否恢复用药。
研究药物为静脉药,均建议在转阴后返院行安全性检查后,由研究者评估决定是否恢复给药。
院内新确诊新冠病毒感染肿瘤患者,参考各省及医院阳性处置流程。如:医院设置独立阳性病区、各病区“红区”优先收治有新冠典型症状患者,特别是65岁以上合并肿瘤等严重基础疾病,且未完成新冠病毒疫苗全程免疫的阳性患者;对具备居家隔离条件的无症状感染者和轻型病例,如无其他医疗需求或达到肿瘤等疾病出院标准的,可闭环转运居家隔离(不乘坐公共交通),向社区报备后按当地疫情防控要求执行。独立阳性病区新冠感染者,新冠相关症状由阳性病区医务人员诊治,注意中医、营养、心理、康复等综合施治,争取早日转阴,肿瘤诊疗由原转出科室负责制定方案,开具医嘱,由阳性病区医务人员执行。建立医患沟通群,及时处理相关问题。体温恢复正常,呼吸道症状明显好转,连续两次核酸检测 CT 值≥35 解除隔离。
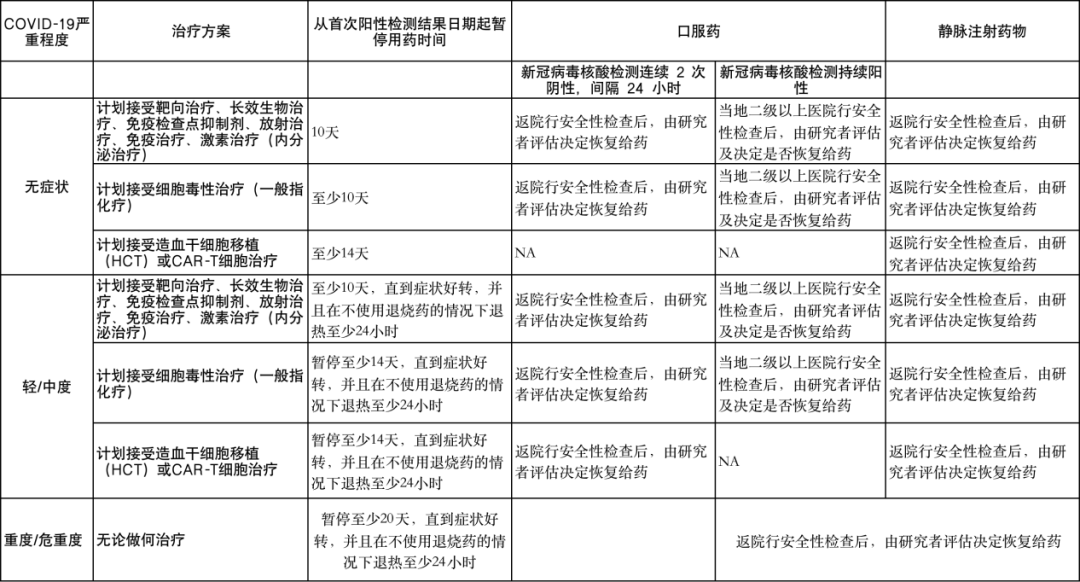
表3 新冠病毒感染肿瘤临床试验患者访视建议
4. 新冠病毒感染肿瘤临床试验患者用药建议
肿瘤患者往往存在免疫力低下且往往伴有其他基础疾病、肝肾功能不全等情况,由于常用的解热镇痛药对乙酰氨基酚对肝肾功能不全患者需慎用,布洛芬对于肾功能不全者使用前也应咨询医师/药师,因此建议肿瘤患者感染后尽量选择在医疗机构就诊治疗。
此外,由于临床试验过程中需要收集合并用药,并且大多方案因研究药物经不同途径代谢,有涉及到药物-药物相互作用研究,因此,对于新冠阳性的肿瘤临床试验患者,需要严格按照方案要求进行合并用药记录,并在用药前咨询研究者,确保用药安全。
5. 新冠病毒感染肿瘤临床试验患者终止治疗/退出研究标准
新冠病毒感染患者发生以下任一情况,研究者可使该受试者终止试验药物治疗:受试者主动要求停止试验;研究者出于安全性考虑(如受试者合并发生不可耐受的不良事件或阳性后发生严重并发症)认为受试者应终止试验药物治疗,达到永久停药标准;受试者妊娠;死亡;受试者出现疾病进展;受试者出现严重方案违背,且研究者认为该方案违背严重影响本试验的主要终点评价,研究者认为该受试者应终止治疗;研究者认为受试者应该终止试验药物治疗的其他情况。
新冠病毒感染期间退出标准:若受试者阳性感染期间发生重大方案违背等情况且研究者判断终止试验药物治疗后不需继续随访,则受试者终止试验药物治疗,并完成末次治疗访视及必要的安全性事件随访后可退出试验。
6. 新冠病毒感染临床试验肿瘤患者安全性事件上报
“新冠病毒感染”的不良事件记录:不良事件应该按照确切的诊断来记录,如肺癌患者出现咳嗽、发热、胸闷等症状,若新冠病毒核酸检测阳性,则在排除疾病本身导致之后,记录为“新冠病毒感染”结果。如果不能记录为确切的诊断,应分别记录单独的体征和症状。每个诊断/症状都应分别记录。不良事件的开始日期是第一次观察到第一个体征或症状的日期或核酸检测阳性。如果不良事件是具有临床意义的异常实验室检测或检查结果,开始时间即是采样日期。如果同一种不良事件在受试者身上发生一次以上(复阳),且受试者在不良事件之间康复过,则此不良事件应按照发生次数分别记录。如果不良事件发生期间其严重程度发生变化,按照单独发生的 AE 重新进行记录。需记录不良事件的名称、发生日期、严重程度、与试验药物的因果关系、医学处理、对试验药物采取的措施、结束时间、是否为严重不良事件(SAE)、转归状态。
因果关系判断由研究者参考临床试验方案、研究者手册、是否合理的时间逻辑、停药后反应、再次使用研究药物后是否加重、是否可以用其他疾病解释等来综合判断。
“新冠病毒感染”作为严重不良事件的定义: 1) 导致死亡; 2) 危及生命; 3) 致先天性异常或致出生缺陷; 4) 导致显著的或者永久的人体伤残或者器官功能的损伤; 5) 导致住院治疗或者住院时间延长。
“新冠病毒感染”不良事件的严重程度判断标准:研究者将参照 NCI CTCAE V5.0、临床研究方案、参考新冠病毒感染严重程度分级,分为:
1 级:无症状或轻度;仅为临床或诊断所见;无需治疗;
2 级:中度;需要较小、局部或非侵入性治疗;居家观察对症治疗;
3 级:重度;严重或者具重要医学意义但不会立即危及生命;导致住院或延长住院时间;致残;自理性日常生活活动受限*;
4 级:危重症;需紧急治疗;
5 级:与AE相关的死亡。
*自理性日常生活活动指洗澡、穿脱衣、吃饭、盥洗、服药等,并未卧床不起。
对符合以上SAE定义的新冠病毒感染,研究者需在获知24h内以书面报告的形式上报申办方,随后应当及时提供详尽、书面的随访报告。与药物的相关性判断参考不良事件判断依据。由申办方决定是否以SUSAR上报。
2. 方案偏离上报
对于所有因为新冠病毒感染导致暂停用药、退出研究等非预期情况发生时,研究者应及时与医学监查员(伦理,必要时)协商,以确定采取适当措施。研究者应记录所有方案偏离,内容包括但不限于方案偏离的发生时间、发现时间、事件的描述和采取的措施等。如发生严重方案偏离,研究中心应及时告知医学监查员、临床监查员、伦理。
7. 肿瘤临床试验患者新冠疫苗接种建议
国外指南中针对参加临床试验的恶性肿瘤患者推荐接种新冠疫苗。为降低参加临床研究肿瘤患者新冠病毒感染风险,参加临床研究受试者原则上不限制接种灭活的新冠疫苗,但具体接种时机应根据临床试验方案由研究者评估。
在新冠疫情防控常态化管理下,新冠病毒感染肿瘤临床试验患者作为特殊人群,在参考日常肿瘤治疗的基础上,也需要严格遵守临床试验方案。研究者需要遵守GCP原则,参考以上应对策略,积极防控,同时患者需做好自我防护,尽最大可能避免感染,保证临床试验顺利开展。
参考文献:
1.新型冠状病毒肺炎疫情期间实体肿瘤患者防护和诊治管理相关问题中国专家共识;
2.NCCN 癌症相关感染的预防和治疗指南 2022.3 版;
3.湖南省新冠肺炎疫情防控指挥部医疗救治组关于印发《医疗机构新冠肺炎就诊流程与医疗服务指南》的通知(湘肺炎防指医发〔2022〕321 号);
4.国家卫健委《新冠病毒感染者居家治疗指南》。

 关注微信公众号
关注微信公众号
